|
"유전자 가위"란?
징크핑거 뉴클레아제
징크핑거 뉴클레아제는 징크핑거와 3~4개의 뉴클레아제(핵산분해효소)가 결합한 것이다. 징크핑거는 1985년에 아프리카 발톱개구리의 유전자를 연구하면서 발견한, 아연(Zn)이 결합된 손가락(finger) 모양의 단백질 구조에서 유래하였다. 1990년대 중반에 미국 존스홉킨스대학의 스리니바산 찬드라세가란(Srinivasan Chandrasegaran)이 특정 DNA 염기서열을 인식하여 결합할 수 있는 징크핑거 단백질 6개를 엮고, 이것을 세균들이 단백질 절단을 위하여 사용하는 제한효소 'Fokl'과 결합함으로써 DNA 인식능력과 절단능력을 결합한 1세대 유전자가위가 탄생하였다. 이 유전자가위는 2000년대 초반부터 유전자 교정기술로 이용되기 시작하여 후천성면역결핍증(AIDS)·혈우병·알츠하이머병 등의 유전적 치료에 활용되고 있다.
탈렌
탈렌은 설계와 제작 과정이 복잡하고 비용이 많이 드는 데다가 사용 중 오작동이 많이 발생하는 징크핑거 뉴클레아제의 문제점을 개선하기 위하여, 식물성 병원체인 잔토모나스(Xanthmonas)를 이용하여 개발한 것이다. 탈렌을 구성하는 아미노산 서열은 절단하는 DNA의 염기서열과 일치하기 때문에 탈렌의 아미노산 서열을 변경하면 결합 대상인 DNA의 염기서열도 달리할 수 있어 단백질을 맞춤식으로 변형하기가 훨씬 수월하다. 탈렌은 징크핑거 뉴클레아제와 마찬가지로 DNA를 절단하는 효소로 Fokl을 사용하는데, 2개의 결합체가 유전자 측면해서 접근해 들어가서 이중나선을 절단하여 세포가 복구할 수 없게 만든다. 2009년 개발되어 2011년 말부터 활용되기 시작한 탈렌 기술에 의하여 C형간염과 고콜레스테롤혈증 등과 같은 질병 모델이 만들어졌다.
크리스퍼
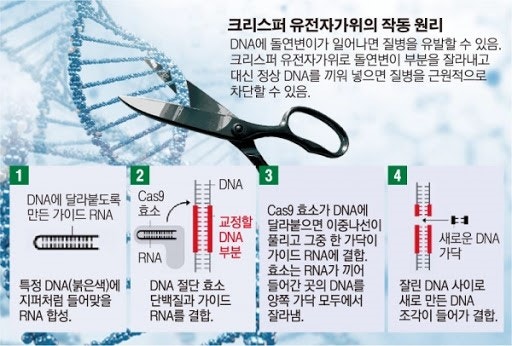
3세대인 크리스퍼 유전자가위는 교정하려는 DNA를 찾아내는 RNA(리보 핵산)와 DNA를 잘라내는 제한효소인 Cas9를 결합하여 만든 것으로, 2012년 말에 개발되었다. 안내 역할을 하는 RNA가 교정을 목표로 하는 DNA 염기서열에 달라붙으면 Cas9가 DNA의 특정 부위를 잘라내는 방식으로 진행되는데, 1세대 및 2세대와 달리 복잡한 단백질 구조가 없고 DNA 절단 정도가 더욱 깊다. 이전 세대의 유전자가위들과 달리 오작동에 대한 보호장치가 없어 자칫하면 엉뚱한 부분을 잘라내 돌연변이를 일으킬 수 있다는 것이 치명적 단점이긴 하지만, 과거에는 유전자 하나를 잘라내고 새로 바꾸는 데 수개월에서 수년씩 걸리던 것이 크리스퍼가 개발되면서 수일 이내로 단축되었을 뿐 아니라 동시에 여러 군데의 유전자를 손볼 수도 있게 되는 등 유전자 교정에 획기적인 발전이 이루어졌다. 개발 이후 각종 동물이나 식물의 형질 개량, 질병 치료, 해충 퇴치부터 인간 배아의 유전체를 교정하는 실험까지 여러 방면의 연구에 활용되고 있으나, 이에 따른 생태계 파괴나 윤리적 문제에 대한 우려도 제기된다.
"최근 동향" 

|